Bereits im Jahr 1996 veröffentlichte die Europäische Arzneimittelagentur (EMA) das Ergebnis des ersten europaweit gültigen Zulassungsverfahrens. Diesem Erfolgsbeispiel folgend wagte die EU-Kommission in 2018 den nächsten logischen Schritt und legte einen Verordnungsentwurf vor, der zukünftig auch die über die Zulassung hinausgehende und bisher im nationalen Rahmen stattfindende Nutzenbewertung von Gesundheitstechnologien europaweit vereinheitlichen soll: das EU-HTA (Health Technology Assessment)-Verfahren. Trotz grundsätzlicher Einigkeit über die Notwendigkeit einer solchen Harmonisierung ist seitdem eine langwierige Auseinandersetzung zwischen den einzelnen Mitgliedsstaaten der Europäischen Union über die Ausgestaltung entbrannt.
1. EU-HTA: Europaweite Bewertung von Gesundheitstechnologien
Das Prinzip des Technology Assessments (Technikfolgenabschätzung) entstand in den 1960er-Jahren in den USA im Zusammenhang mit innovativen Technologien wie Überschallflugzeugen und genetischem Screening und fand aufgrund zahlreicher medizinischer Neuerungen in diesem Zeitraum bereits nach kurzer Zeit als Health Technology Assessment (HTA) den Einzug in den Gesundheitssektor[1]. HTA beschreibt einen Prozess der systematischen Bewertung von Gesundheitstechnologien, der basierend auf der verfügbaren wissenschaftlichen Evidenz, medizinischen Entscheidungsträgern, Krankenkassen, Patienten und weiteren Beteiligten eine Aussage über den therapeutischen Mehrwert einer neuen Gesundheitstechnologie gegenüber den bestehenden Alternativen ermöglicht.
[1] Banta, David (Summer 2019). „What is technology assessment?“. International Journal of Technology Assessment in Health Care.
2. Nutzen eines europäischen HTA-Verfahrens
Im Gegensatz zur europaweit einheitlichen Zulassung von neuen Arzneimitteln durch die Europäische Arzneimittelagentur (EMA) findet das anschließende HTA – in Deutschland ist das die (Zusatz-) Nutzenbewertung (AMNOG) durch IQWiG und G-BA – bisher weit überwiegend auf nationaler Ebene statt. Dies kann zu ungleichen und verzerrten Marktzugangsbedingungen führen, da sich die nationalen HTA-Verfahren teils deutlich beispielsweise hinsichtlich ihrer Akzeptanz bestimmter Endpunkte oder der einzureichenden Datenbasis unterscheiden. So kann es mitunter sein, dass ein Arzneimittel in einem Mitgliedsstaat der EU erstattet wird, während es in einem anderen den Patienten nicht zur Verfügung steht.
Hier soll ein europaweit einheitliches Verfahren die skizzierten Probleme lösen nach dem Prinzip: „Ein HTA-Verfahren für ein Arzneimittel“.
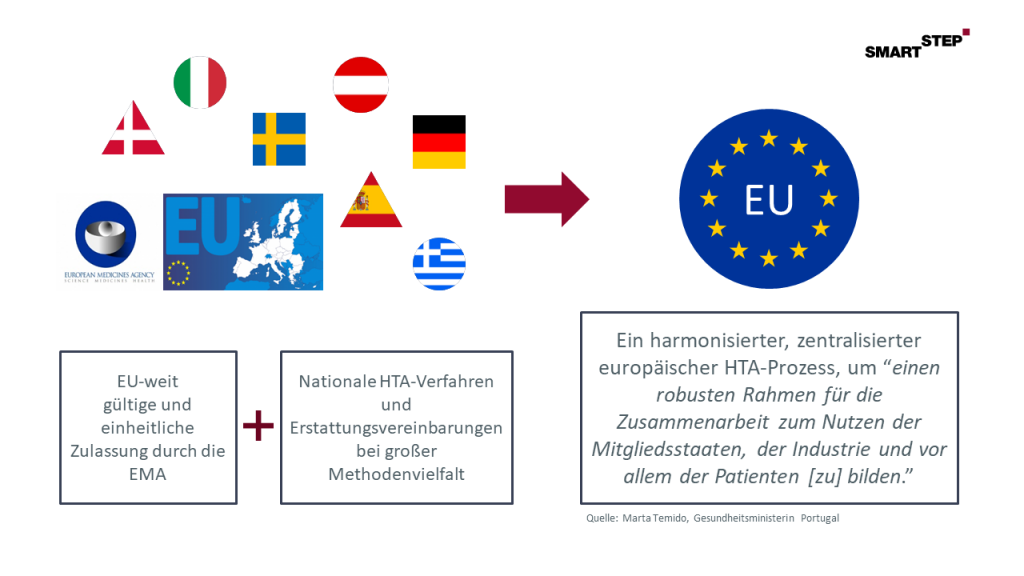
Abbildung: Hintergrund und Begründung für ein europäisches HTA-Verfahren
3. EU-HTA: Verordnungsentwurf der Europäischen Kommission
Bereits 2018 hat die EU-Kommission einen Verordnungsentwurf vorgelegt, der im Anschluss zu intensiven Diskussionen über dessen Ausgestaltung zwischen den Mitgliedsstaaten geführt hat. Vor allem die größeren Mitgliedsstaaten wie Deutschland und Frankreich, die bereits über eine ausgereifte HTA-Systematik verfügen, lehnen den vorgeschlagenen, weit in bisher nationale Entscheidungskompetenzen hineinreichenden Entwurf ab. Zentraler Diskussionspunkt ist zum einen die Frage, ob das Ergebnis europaweit durchgeführter Verfahren verbindlich durch die Mitgliedsstaaten übernommen werden muss. Hier wird vor allem eine indirekte Absenkung der bisher geltenden hohen Standards in einigen Mitgliedsländern befürchtet. Außerdem greife ein verpflichtend zu übernehmendes Nutzenbewertungsergebnis direkt in die nationale Entscheidungsbefugnis über den Erstattungspreis ein, da sich dieser immer direkt am Ergebnis der Nutzenbewertung orientiert. Ein weiterer Knackpunkt ist die Festlegung der Methodik zur Nutzenbewertung in der Verordnung.

Abbildung: Die vier Hauptabschnitte des Verordnungsentwurfs von 2018
4. EU-HTA: Verlauf und Ausblick des Verfahrens
4.1 Subsidiaritätsrüge: Blockadehaltung von Deutschland und Frankreich
Inzwischen haben sich die Mitgliedsstaaten durch eine gemeinsame Position im Rat der Europäischen Union darauf geeinigt, dass die Idee eines europäischen HTA-Verfahrens grundsätzlich umgesetzt werden soll. Die wesentlichen vorausgegangenen Diskussionspunkte sind in diesem Verhandlungsmandat, welches nun als Grundlage für die abschließende Diskussion im Europaparlament dient, aber eindeutig in Form getroffener Kompromisse wiederzufinden.
Ebenfalls im Jahr 2018, kurz nach Vorlage des Verordnungsentwurfs, legten Deutschland und Frankreich zusammen mit weiteren Mitgliedsstaaten eine förmliche Subsidiaritätsrüge vor, die im Kern die zuvor geäußerte Kritik unterstrich und die Kommission dazu aufforderte, die Verordnung auf eine andere gesetzliche Grundlage zu stellen. Statt Artikel 114 des Vertrags über die Arbeitsweise der Europäischen Union (AEUV), dessen Intention die Herstellung eines Binnenmarktes in der EU ist, soll Artikel 168 AEUV die Grundlage bilden. Dies ist ein Artikel, der die nationale Entscheidungsbefugnis der Mitgliedsstaaten unterstreicht, indem Entscheidungen immer dann auf nationaler Ebene zu treffen sind, wenn eine Entscheidung auf Ebene der Union nicht zwingend notwendig ist (Subsidiaritätsprinzip). Insgesamt beteiligten sich zwar zu wenig Länder, um den Rechtsetzungsprozess aufzuhalten, die Auseinandersetzung mit den vorgetragenen Kritikpunkten führte aber zu einem langandauernden Austausch der Positionen im Rat der Europäischen Union, dem direkten Vertretungsgremium der Mitgliedsstaaten in der EU.
Neben großen inhaltlichen Differenzen, die eine schnelle Realisierung des Vorhabens verhinderte, führte Anfang 2020 zusätzlich die COVID-Pandemie dazu, dass weitere Verhandlungen über die Ausgestaltung der Verordnung insgesamt ein knappes Jahr unterbrochen wurden und erst im März 2021 eine gemeinsame Position der Mitgliedsländer veröffentlicht werden konnte.
4.2 Aktueller Stand: Das Verhandlungsmandat
Inzwischen haben sich die Mitgliedsstaaten durch eine gemeinsame Position im Rat der Europäischen Union darauf geeinigt, dass die Idee eines europäischen HTA-Verfahrens grundsätzlich umgesetzt werden soll. Die wesentlichen vorausgegangenen Diskussionspunkte sind in diesem Verhandlungsmandat, welches nun als Grundlage für die abschließende Diskussion im Europaparlament dient, aber eindeutig in Form getroffener Kompromisse wiederzufinden.

Abbildung: Auszug aus dem Verhandlungsmandat
5. Wann ist mit einem vollständigen EU-HTA zu rechnen und worauf müssen sich Hersteller vorbereiten?
Über 2 Jahre nachdem die EU-Kommission einen ersten Vorschlag unterbreitet hat, können nun, nachdem sich die Mitgliedsstaaten auf eine gemeinsame Position geeinigt haben, alle am Gesetzgebungsprozess beteiligten Institutionen – Kommission, Parlament und Rat – in einem Trilog eine zeitnahe Umsetzung des Vorhabens realisieren.
5.1 Wie wird sich das EU-HTA-Verfahren zukünftig in bestehende Prozesse einordnen?
Die klinische Bewertung durch ein EU-HTA wird und – insoweit sind sich die Verhandlungspartner im europäischen Prozess einig, – soll die Notwendigkeit zur Einordnung in den jeweiligen nationalen Versorgungskontext nicht ersetzen. Für Deutschland bedeutet dies zum Beispiel, dass auch in Zukunft ein nationales Nutzendossier notwendig sein wird. Wie genau dieses Dossier aussehen wird, ob und welche Timeline-Konflikte es mit dem europäischen Dossier, anschließenden Stellungnahmen und Anhörungen geben wird hängt aber direkt vom Ergebnis der europäischen Verhandlungspartner ab. Dies betrifft auch den Aspekt, wie nationale Bewertungsaufgaben unter IQWiG und G-BA in Zukunft aufgeteilt sein werden. Ein ausführlicher „Scan“ der denkbaren Optionen eröffnet hier die Möglichkeit, schnell auf kommende Entwicklungen einzugehen und nationale Strategien mit dem europäischen HTA-Prozess in Einklang zu bringen.
5.2 Welche Produkte kommen als Erstes für ein EU-HTA-Verfahren infrage?
Sowohl der Verordnungsentwurf der EU-Kommission als auch das Verhandlungsmandat des Rates der Europäischen Union sehen ein stufenweises Inkrafttreten der Verordnung vor. Und auch wenn die finale Abstimmung der Timeline vom Verhandlungsergebnis des Trilogs abhängt, spricht aufgrund der Übereinstimmung der gemachten Vorschläge in diesem Punkt vieles für eine Übernahme des aktuellen Ratvorschlags.
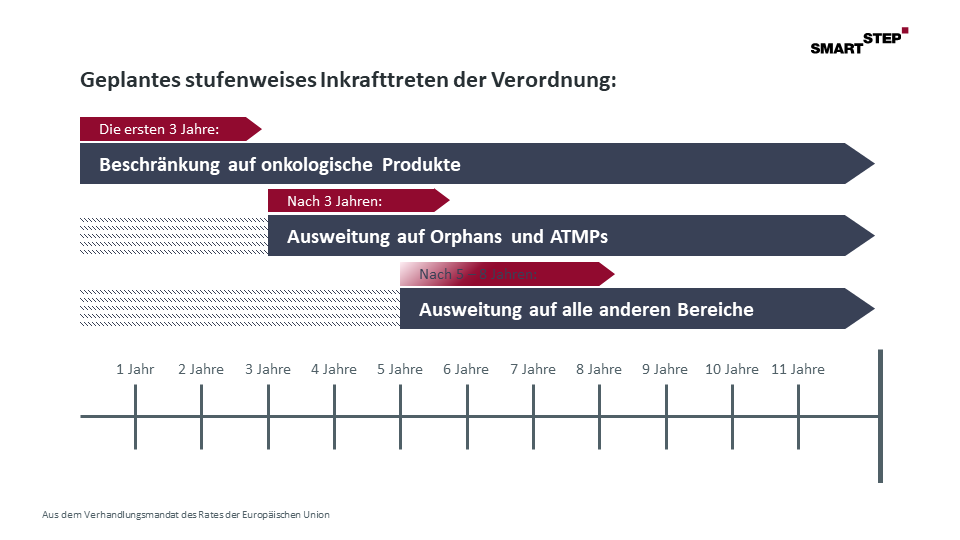
Abbildung: Geplantes Stufenweises Inkrafttreten der Verordnung:
(Aus dem Verhandlungsmandat des Rates der Europäischen Union)
Sie haben Fragen?
SmartStep Consulting begleitet den Entstehungsprozess des EU-HTA-Verfahrens intensiv seit seinem Beginn im Jahr 2018. Durch umfangreiche Erfahrungen im nationalen Nutzenbewertungsprozess und Mitgliedschaften in mehreren europäischen Partnerverbünden (PHAROS, EUCOPE) sind wir bestens aufgestellt, stark vernetzt und Ihr zuverlässiger Partner in den Bereichen Marktzugangsstrategie, Erstellung von Dossiers und in der frühen Beratung. Dies betrifft sowohl AMNOG-Verfahren als auch zukünftige EU-Projekte.
Kontaktiere Sie uns einfach per Email und wir beraten Sie gern!
