Auch nach Neueinreichung aufgrund neuer wissenschaftlicher Erkenntnisse ist die Qualität der neu generierten Studiendaten entscheidend.
In der Verfahrensordnung (g-ba.de) (VerfO) des Gemeinsamen Bundesausschusses (G-BA) sind im 5. Kapitel § 13 die Anforderungen an ein Dossier wegen neuer wissenschaftlicher Erkenntnisse festgelegt. Hierbei kann der G-BA auf Antrag seiner Mitglieder oder der in § 139b Absatz 1 Satz 2 Sozialgesetzbuch (SGB) V genannten Organisationen und Institutionen eine erneute Nutzenbewertung eines zu bewertenden Arzneimittels wegen neuer wissenschaftlicher Erkenntnisse frühestens ein Jahr nach dem Beschluss über eine Nutzenbewertung nach § 20 beschließen. Dies gilt auch, wenn das Anwendungsgebiet des Arzneimittels durch die zuständigen Zulassungsbehörden eingeschränkt worden ist. Über dies ist hierunter auch geregelt, dass dem pharmazeutischen Unternehmer eine Beratung nach § 7 anzubieten ist.
Bisher führte der G-BA neun Verfahren unter § 13 durch (Stand: Dezember 2022) – hierunter wurden innerhalb von drei Verfahren (33,3 %) die Studiendaten durch den G-BA für eine Bewertung der neuen wissenschaftlichen Erkenntnisse herangezogen, drei pharmazeutische Unternehmen stellten die Studiendaten im eingereichten Dossier nicht dar (33,3 %), einmal (11,1 %) reichte der pharmazeutische Unternehmer kein Dossier ein und zwei Studien (22,2 %) wurden durch den G-BA als nicht geeignet für die Ableitung eines Zusatznutzens eingestuft.
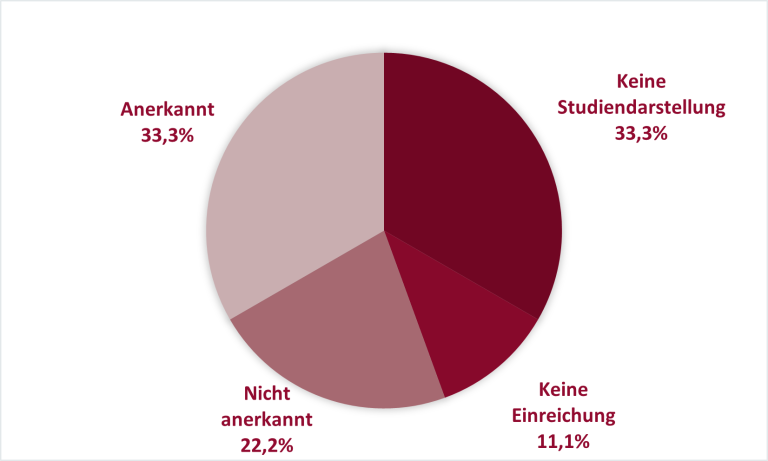
Abbildung 1: G-BA Bewertungen der vorliegenden Evidenz
Warum wurden Studien nicht eingereicht?
In einem Fall wurde kein Dossier zur erneuten Nutzenbewertung eingereicht, da es laut Hersteller aufgrund der bestimmten zweckmäßigen Vergleichstherapie methodisch nicht möglich war, einen Zusatznutzen auf Basis einer direkt vergleichenden Studie darzustellen und eine Inhomogenität des Patientenkollektivs der vorhandenen Studien keinen indirekten Vergleich zuließ.
Bei einem Verfahren in einer onkologischen Indikation entsprach die untersuchte Studienpopulation nicht den vom G-BA definierten Patientengruppen. Bei zwei weiteren onkologischen Präparaten lagen zum Zeitpunkt der erneuten Nutzenbewertung noch keine vergleichenden Ergebnisse vor. Grundlage der Aufforderung durch den G-BA waren jeweils Änderungen im Anwendungsgebiet der Substanzen aufgrund von frühen Signalen aus den damals noch laufenden Studien.
Betrachtet man die Fälle, die durch den G-BA nicht herangezogen wurden, stellen die Patientenpopulation, die festgelegte zweckmäßige Vergleichstherapie und die Umsetzung der Fachinformation in den klinischen Studien bekannte Hürden innerhalb der Bewertung durch den G-BA dar.
Warum werden Studiendaten mit neuen wissenschaftlichen Erkenntnissen nicht herangezogen?
Der Antrag der Mitglieder für eine erneute Nutzenbewertung gemäß § 35a Abs. 1 SGB V i.V.m. § 3 Abs. 1 Nr. 4 AM-NutzenV und 5. Kapitel § 13 VerfO für eine Substanz im Therapiegebiet der Muskel-Skelett-Erkrankungen wurde nach einer Überprüfung des Sicherheitsprofils im Rahmen der Pharmakovigilanz gestellt. Laut dem G-BA stellt dies für die Patientinnen und Patienten in der für die Neubewertung maßgeblichen Studie unter Berücksichtigung der Warnhinweise und Vorsichtsmaßnahmen für die Anwendung nach der Aktualisierung der Fachinformation keine adäquate Behandlung mehr dar.
Der zweite Fall betrifft ein Präparat im Therapiegebiet der Infektionskrankheiten im Jahr 2022. Hierbei begründet der G-BA, dass die Studie nicht zur Ableitung eines Zusatznutzens geeignet sei und nicht als neue Evidenz im vorliegenden Anwendungsgebiet angesehen werden kann. Als Gründe nennt der G-BA die fehlende Umsetzung der zweckmäßigen Vergleichstherapie sowie die nicht vollumfängliche fachinformationskonforme Dosierung.
Beratungsgespräch vor Marktzugang
Antizipieren lässt sich der mögliche Ausgang eines Verfahrens durch eine strategisch gut geplante und zeitlich maßgeschneiderte Vorgehensweise. Hierbei stellt das Beratungsgespräch den ersten wichtigen Meilenstein vor dem Marktzugang und während des Lebenszyklus jedes Arzneimittels dar. Eine Produkt-gerechte Darstellung der medizinischen Evidenz, umfangreiche Recherchen zur zweckmäßigen Vergleichstherapie sowie die spezifische Vorbereitung des G-BA Beratungsgesprächs interdisziplinärer Teams gehören zu den Hauptstellschrauben für einen erfolgreichen Marktzugang und den Fortbestand am Markt.
Sie haben Fragen?
Kontaktieren Sie uns einfach per E-mail und wir beraten Sie gern!
